Odkritja človeškega genoma, vse natančnejši podatki o delovanju genov in o njihovih medsebojnih odnosih so povzročili, da si lahko natančneje predstavljamo, kako delujejo zdrave celice človeškega organizma. Na videz povsem različni pojmi, ki smo jih našteli v vprašanju kaj imajo skupnega zdrava celica, tumorska celica in tarčna zdravila, so v resnici med sabo neločljivo povezani. Poskusimo na nekoliko poenostavljen način ugotoviti, kakšne so povezave med njimi. Zaradi novih spoznanj v biologiji in medicini lahko že bolj razumemo, kako se iz celic našega organizma razvije tumorska celica. Pravzaprav v tako nastali maligni celici ni nič novega, le sistemi, ki nadzorujejo delovanje genov, ne funkcionirajo več na običajen način. Številnih napak, ki vsakodnevno nastajajo v zgradbi našega genoma, nadzorni sistem ne zna več popraviti, okvarjena celica se ne postara ali pri nepopravljivi napaki ne umre, tako kot bi se spodobilo in je v takih primerih tudi načrtovano. Danes zanesljivo vemo, da vznikne prva celica novonastalega tumorja iz ene same v množici zdravih celic naših tkiv. Proces, pri katerem v taki celici nastane nepopravljiva tragična sprememba običajnega genskega materiala, imenujemo karcinogeneza. Na žalost pa smo ugotovili tudi to, da tumorske celice razen relativne ali absolutne avtonomije v rasti nimajo novih, dramatičnih značilnosti, ki bi jih lahko izkoristili za uspešno zdravljenje.
NESMRTNOST MALIGNE TUMORNE CELICE
Vsaka naša zdrava telesna celica ima glede na organ (jetra, možgani, žleze, koža, krvne celice) svojo značilno življenjsko dobo. Prav nasprotno pa so relativno hitra rast, ponovitve bolezni in kasnejši zasevki pri malignih tumorjih posledica neobičajno močnega delovanja posebnih genov (onkogenov), ki kodirajo rastne faktorje, receptorje ali beljakovine, ki prevajajo celične signale. Zaradi tako spremenjenih signalnih poti se začno tumorske celice hitreje deliti in njihovo število in s tem velikost tumorja nezadržno naraščata. Nasprotni proces, proces apoptoze, ki skrbi v zdravem organizmu za umiranje nepopravljivo prizadetih celic, pa je pri tumorjih zavrt zaradi motnje drugih genov, ki to apoptozo nadzirajo. K nesmrtnosti maligne tumorske celice prispeva še ena biološka značilnost. Pri zdravih celicah so po vsaki delitvi končni segmenti kromosomov (telomeri) krajši. Ko se po določenem številu povsem skrajšani, se celica neha deliti. V tumorski celicah pa se pojavi encim telomeraza, ki ga v večini zdravih celic ni. Encim pri vsaki delitvi prepreči, da bi se telomerni konci skrajšali. Ker se telomerni konci pri delitvi ne krajšajo več kot v zdravih celicah, transformirana tumorska celica nima več omejenega števila delitvenih ciklusov. Celica se začne nebrzdano deliti, postala je nesmrtna.
Tako, nič več nadzorovano množenje tumorskih celic povzroča vse hitrejšo tumorsko rast. Novemu divjanju celic nista več kos niti že od prej zavrta apoptoza, niti odmiranje tumorja, ki bi lahko nastalo, če bi bila motena njegova prekrvitev.
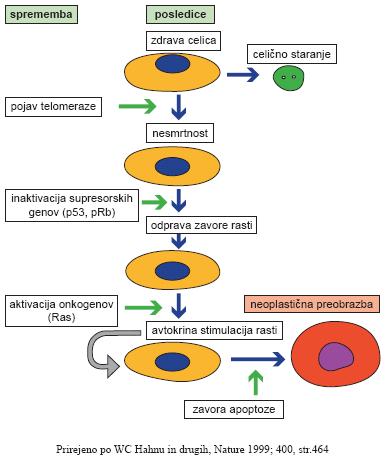
PREOBRAZBA CELICE
Na skici vidimo poenostavljene stopnje maligne transformacije. Na prvi stopnji povzroči pojav telomeraze nesmrtnost doslej zdrave celice in ji prepreči, da bi se postarala. Na drugi stopnji tega procesa zaradi inaktivacije tumorskih zaviralnih genov (p53, pRb) ni več običajne rastne zavore in celice se vse hitreje delijo. Na tretji stopnji se aktivirajo onkogeni, ki že nebrzdano rast samo še pospešijo. V celici začno nastajati rastni faktorji, za katere celica že ima receptorje, ali pa na novo nastanejo receptorji za tiste rastne faktorje, ki jih celica že prideluje. Novonastali proces imenujemo avtokrina stimulacija rasti. Celica se je tako že po nekaj stopničkah prelevila iz spodobne in nadzorovane živalice v agresivno, ves organizem ogrožujočo zverinico.
Kaj so tumorski supresorski geni?
Tumorski supresorski ali zaviralni geni skrbijo v zdravih celicah za ohranitev genoma. Njihova prva naloga je, da popravljajo okvare, ki nenehno pojavljajo na naši DNK, druga pa ta, da zavirajo rast ali celo sprožijo celično smrt, če je DNK povsem okvarjena. Med gene te vrste spadajo p53, Rb1, BRCA1, BRCA2 pa tudi mnogi drugi.
Kaj so onkogeni?
Čeprav jih imenujemo onkogeni, povzročitelji tumorjev, so geni te vrste (myc, src, sis, erbB in drugi) evolucijsko zelo stari, saj jih imajo že protozoi. Zato je biološko logično, da so v zdravem organizmu nadvse koristni. Nepogrešljivi so pri tako pomembnih procesih, kot so celična in tkivna rast, pri diferenciaciji tkiv v zarodku in pri najrazličnejših celjenjih. Tumorje povzročajo šele, ko so zaradi mutacije okvarjeni in postanejo preveč aktivni, ali takrat, ko se tako namnožijo, da postanejo v celici njihovi končni produkti, onkoproteini, preobilni.
Kaj je tarčno zdravljenje v onkologiji?
Maligni tumorji so različne vrste malignih bolezni z mnogokrat dramatičnimi kliničnimi slikami in celo smrtnim izidom. Doslej za to heterogeno skupino še nimamo zadovoljivo učinkovitega zdravljenja.
Ko so odkrili, katere spremembe povzročajo prehod zdravih celic v »ekscentrične« maligne celice, je postalo logično, da bi lahko maligne celice obvladali le tako, da bi vplivali na tiste mehnizme v celici, ki so spremenjeni, torej značilni za maligno celico. Ker so genetski razlogi pri različnih tumorjih različni, so tudi mesta molekulskih sprememb pri različnih tumorjih različna. Če bi lahko pri določeni vrsti tumorja vplivali samo na te, zanj značilne spremembe, bi na molekularni ravni zadeli pravo in za tumorsko rast odgovorno tarčo. Na tak način bi dobili visokospecifično »tarčno« zdravilo. Zdravilo take vrste ne bi vplivalo na običajne celice organizma, saj v zdravih celicah ni malignih tarč. Sopojavov, tako značilnih za kemoterapijo, zato pri tarčni terapiji ne bi smelo biti ali bi morali biti veliko blažji. Tarčna zdravila, osnova tarčnega zdravljenja, so torej tiste na novo pridobljene učinkovine, ki so usmerjene le proti tistim molekulskim sistemom, ki so značilni za maligne celice posamične vrste tumorja.
VRSTE TARČNIH TERAPIJ DANES
Spoznali smo že, da ima novonastala maligna celica spremenjene različne biološke sisteme. Ni torej naključje, da so raziskovalci poskušali pripraviti zdravila, ki bi učinkovala na različna prijemališča v tumorskih celicah. Uspelo jim je že na več področjih. Glede na klasifikacijo, ki jo je uvedel Nacionalni inštitut za rak (NCI) v Združenih državah Amerike, poznamo že nekaj vrst tarčnih zdravil:
- zdravila malih molekul,
- monoklonska protitelesa,
- zdravila za sprožanje apoptoze,
- inhibitorje angiogeneze,
- kancerske vakcine,
- prava genska zdravila.
Zdravila malih molekul
Skupna lastnost tarčnih zdravil te vrste (Tarceva pri nekaterih pljučnih karcinomih, Iressa pri kronični mieloični levkemiji, Gleevec pri gastrointestinalnih stromalnih tumorjih) je ta, da zavro aktivnost transmembranskih beljakovinskih receptorjev (tirozinskih kinaz). Pri malignih tumorjih so se na te receptorje vezali rastni faktorji in s tem aktivirali v celicah signalne poti, ki so pospeševale nebrzdano proliferacijo tumorskih celic. Zdravila malih molekul, imenovana tudi inhibitorji tirozinskih kinaz, preprečijo delovanje rastnih faktorjev na signalne poti in tako zavro tumorsko proliferacijo.
Kaj so monoklonska protitelesa?
Monoklonska protitelesa (Rituxan pri malignih limfomih, Herceptin pri karcinomih dojke, Avastin pri nekaterih karcinomih in drugi) so z genskim inženiringom pridobljena protitelesa, usmerjena proti tarčnim antigenom, ki so praviloma le na tumorskih celicah. Smrt tumorskih celic povzročijo tako, da se vežejo na značilni tumorski antigen in nato podobno kot zdravila malih molekul blokirajo signalne poti, ki so vodile do prekomerne celične proliferacije. Monoklonska protitelesa lahko uporabimo tudi kot prenašalce citotoksičnih substanc do malignih celic.
Kako delujejo inhibitorji angiogeneze?
Tumorska angiogeneza je proces, pri katerem nastajajo v tumorskem tkivu nove krvne žile. Samo te, na novo nastale žile omogočajo tumorju, da raste, so pa tudi pogoj, da lahko maligne celice preidejo v krvni obtok, in pogoj za nastanek zasevkov. Inhibitorji angiogeneze (Celebrex pri kolorektalnem karcinomu, Revlamid pri multiplem mielomu, Sunitinib pri ledvičnem karcinomu in drugi) delujejo na več prijemališčih. Na eni strani blokirajo rastne faktorje, ki sprožajo nastanek tumorskega žilja (med njimi je posebno znan vaskularni endotelni rastni faktor - VEGF), na drugi zavirajo snovi, ki spodbujajo žilne rastne faktorje, na tretji pa neposredno zavirajo rast notranjih slojev krvnih žil.
Apoptoza
Apoptoza je naravni proces programirane celične smrti in je odgovorna predvsem za odmiranje postaranih zdravih celic. Apoptoza skrbi tudi za to, da v organizmu odstranimo odvečne, poškodovane ali nepopravljivo spremenjene celice. Pri malignih tumorjih je proces apoptoze mnogokrat zavrt, kar samo še veča število tumorskih, nesmrtnih celic. Tarčna zdravila te vrste (Velcade pri multiplem mielomu, Genasse pri pljučnem karcinomu, levkemijah in nekaterih limfomih) znova vzpostavijo apoptozo, tako da v tumorskih celicah zavirajo nekatere molekulske procese in s tem sprožijo njihovo hitrejše odmiranje.
Zakaj so pomembne tumorske vakcine?
Karcinomske vakcine so genetsko pridobljena cepiva proti antigenom, ki so specifični za tumorske celice ali pa so vsaj na tumorskih celicah obilnejši kot na celicah zdravih tkiv. Nekatere vakcine so pomembne v preventivi (Gardasil za preprečevanje karcinoma vratu maternice, ki ga sprožajo humanimi virusi papiloma), druge pri zravljenju (Provenge pri karcinomu prostate).
USPEŠNOST GENSKIH ZDRAVIL
O genskem zdravljenju govorimo takrat, kadar vnesemo v celico nov funkcionalni gen ali če skušamo zamenjati okvarjeni gen z novim, zdravim. Gensko zdravljenje malignih tumorjev je še vedno na začetni stopnji. Težave so predvsem v tem, da moramo vnesti nov gen le v tumorske celice in ne v celice zdravega tkiva, da vstavimo gen na prav določeno mesto v DNK in da je količina vnesenega gena dovolj velika. Načeloma stremimo k temu, da bi vnesli v tumorsko celico manjkajoče tumorske supresorske gene, zamenjali aktivne onkogene z neaktivnimi ali vnesli v celico tako imenovane samomorilske gene, ki bi sprožili nastanek posebnih encimov, ki lahko v tumorski celici nato spremenijo neaktivno obliko kakega zdravila v aktivno obliko kemoterapevtika. Raziskave te vrste so usmerjene predvsem na gene za p53, tumorski nekrozni faktor alpha in še nekatere druge.
Medicinska fakulteta Maribor